大阪大学免疫学フロンティア研究センター 免疫システム学研究室
Daron Standley
PDIS事業における私たちのプロジェクトは、高スループットな実験結果からタンパク質とリガンドの相互作用を同定するソフトウェアを開発することから始まりました。このプロジェクト初期に支援を行っていた実験系研究室では、タンパク質中のアミノ酸残基があるリガンドと結合するのに重要かどうかを識別するために、特定のアミノ酸残基に変異を誘発しその解析を行っており、多くの突然変異誘発データが蓄積されていることがわかりました。稲垣冬彦教授(北海道大)の研究室では、Toll様受容体シグナル伝達経路にあるアダプター分子であるタンパク質TRAMとTRIFによる三分子複合体の結合に重要なアミノ酸残基を特定するために、点変異を導入した対象タンパク質を作製し酵母ツーハイブリッド法を用いてその結合状態を解析していました。私たちは、その複合体モデルを構築し、私たちが開発した力場(Liang et al., 2011)を用い、個々の変異から結合エネルギーの変化を評価することによって、複合体モデルの有効性を実証しました(Enokizono et al., 2013)。
すでに多くの研究があるタンパク質同士の複合体モデルでは、多くの場合、複合体形成の前後で結合するタンパク質の形状が大きく変化しないことを前提としています。しかし、タンパク質とRNAの結合を考える上では、RNAの変形を考慮する必要があります。この効果を考慮するために、私たちは、タンパク質のアミノ酸配列と予想した構造を用いてRNAの構成単位であるヌクレオチドが結合するタンパク質の部位を予測するための既存の予測法をしのぐ優れた方法を開発しました(Li et al., 2014)。これにより予想される結合部位を前提に、完全に自由に動くRNA分子について粗視化分子動力学シミュレーションを実行しました(Li , in preparation)。この構造可変ヌクレオチド鎖結合プラットフォームを用いて、STAT3の mRNAによる転写後制御因子であるArid5aへの結合(Masuda et al., 2016)、インターロイキン6のmRNAによる転写後制御リボヌクレアーゼRegnase-1への結合(Yokogawa et al., 2016)、HIVゲノムRNAによる宿主防御タンパク質APOBEG3Gへの結合(Izumi et al., submitted)など多くの研究に対して活用し支援を行いました。このように本プログラムで求められている研究支援と高度化の好循環をうまく機能させることができました。
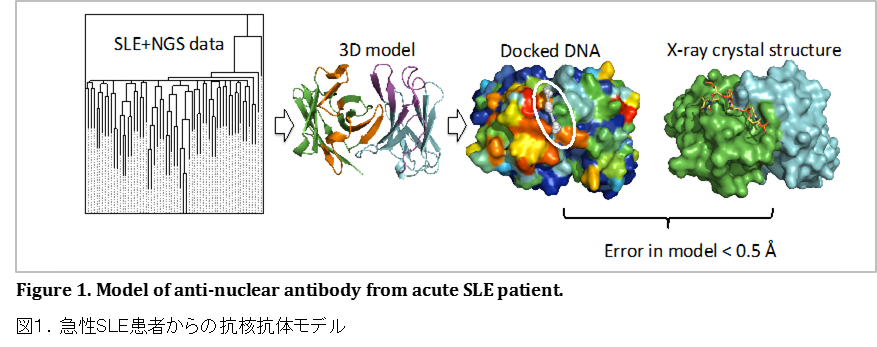
本プログラムでは、さらにバイオインフォマティクスと実験科学が十分な連携を取ることで日本の創薬を加速することが求められています。バイオインフォマティクスを創薬に活かすためには、バイオインフォマティクス研究者は、実験研究者からの要望を待つのではなく積極的にアプローチすることが重要であり、創薬に対する研究の方向性を先取りして実験研究者に示す必要があります。バイオインフォマティクス研究室で行われている化合物の標的タンパク質への結合の研究、つまり、仮想的スクリーニングは、この化合物創薬の方向性を探索することなのです。では、私たちのようなタンパク質モデルの構築を行う研究室では何ができるでしょうか。現在、医薬品市場において急速に成長している分野は、小分子医薬ではなく、極めて高い結合特異性をもつ抗体などの生物学的製剤です。最近、末梢B細胞あるいは末梢T細胞の次世代シーケンサーを用いた解析により、B細胞受容体およびB細胞受容体に類似した形状・機能をもつ分子であるT細胞受容体の全ての「レパトア」が同定できるようになりました。免疫細胞であるT細胞やB細胞は多様な抗原に反応できるように、各々の抗原に対して特異的に反応する受容体を発現しており、ある抗原に特異的に反応する受容体の総体がレパトアです。多様なレパトアの存在は反応する抗原の多様性を表しています。この新たなデータを活用するために、私たちはB細胞受容体/抗体およびT細胞受容体のモデル構築のために高速かつ正確で高スループットのプラットフォームを開発しました(Schritt et al., in preparation; Shirai et al., 2014; Yamashita et al., 2014)。私たちは、菊谷 仁教授(大阪大)および高木淳一教授(大阪大)と共同で、急性全身性エリテマトーデス(SLE)患者の末梢血から次世代シーケンサーにより塩基配列を計測し、その配列から抗核抗体のモデルを作製し、それに一本鎖DNAを結合させました(Sakakibara, S. et al., submitted)。その結果、図1に示すように、実測された結晶構造と0.5Å未満の誤差で一致する結合複合体モデルを構築することができました。これにより、抗体に対しても、そのモデルを構築し構造可変ヌクレオチド鎖を結合させる方法論の有効性を実証することができました。
このB細胞受容体/抗体およびT細胞受容体は、疾患に対する高感度のバイオマーカーとも考えることができます。B細胞受容体/抗体およびT細胞受容体モデル構築のためのプラットフォームの中には、それらを同一の標的抗原で分類するためのツールも含んでいます。このツールを用いると、健常人および患者のB細胞またはT細胞レパトアを比較することによって、疾患に関連するB細胞受容体やT細胞受容体の割合がわかります。
このように、私たちは生物学的製剤創薬を目指して努力を続けています。