| 所属 |
① 大阪大学 大学院生命機能研究科 ② 大阪大学 大学院生命機能研究科 ③ 大阪大学 大学院薬学研究科 |
|
|---|---|---|
| 氏名 |
① 難波 啓一 ② 宮田 知子 ③ 谷野 弘樹 |
|
| AMED 事業 |
課題名 | クライオ電子顕微鏡による生体高分子構造解析の支援と高分解能化・高速化・自動化を目指した高度化 |
| 代表機関 | 大阪大学 | |
| 代表者 | 難波 啓一 | |
クライオ電子顕微鏡、単粒子像解析、立体構造解析、構造生命科学、創薬支援
当研究グループはクライオ電子顕微鏡による生体高分子の構造解析について支援を行う。大阪大学の大学院生命機能研究科ナノバイオロジー棟1階共同利用施設および同薬学研究科に設置した、3台のクライオ電子顕微鏡、3台の汎用電子顕微鏡、そして1台の細胞組織クライオ切片作成用FIB-SEMを活用し、構造解析技術の高度化を進めつつ、国内外のアカデミアや企業の研究グループに向けて構造解析支援を実施する。
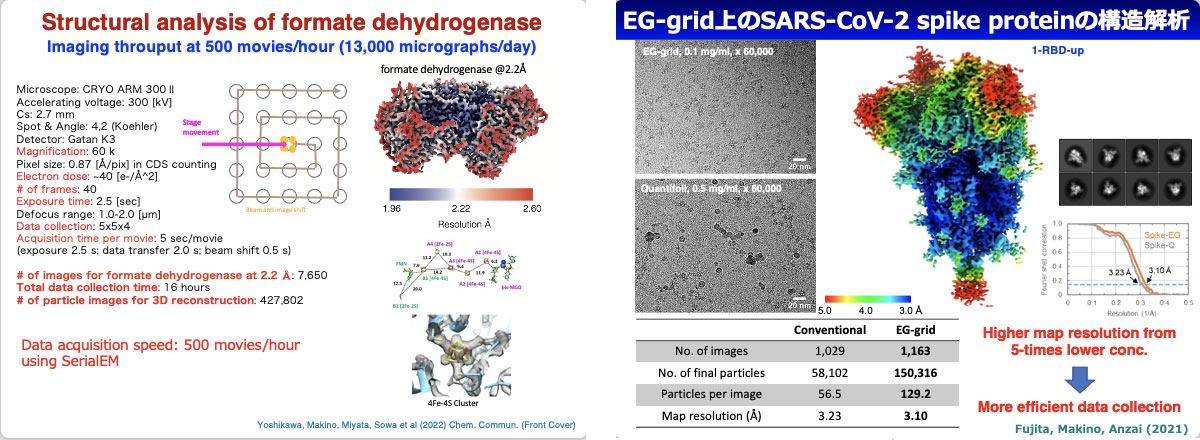
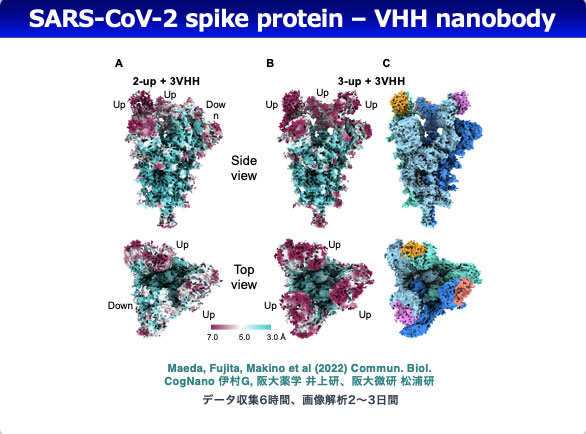
クライオ電子顕微鏡による単粒子像解析法は、僅か数μgの水溶液試料から高分解能の生体分子構造解析を可能にする技術である。ホーリーカーボン電顕グリッド上に濃度0.1~1.0 mg/mlの試料水溶液を2 μl程度載せ、その大半を濾紙でブロットしてホール内に薄膜を形成し、グリッドを液体エタンで急速凍結して生体分子を氷薄膜に包埋する。それをクライオ電子顕微鏡に挿入し、数百~数千枚の電子顕微鏡像を撮影して収集した数十万の分子像の解析によりその立体構造を高分解能で解析する。当研究グループはこの技術を活用し、膜タンパク質を含む生体分子複合体の構造解析支援を実施する。


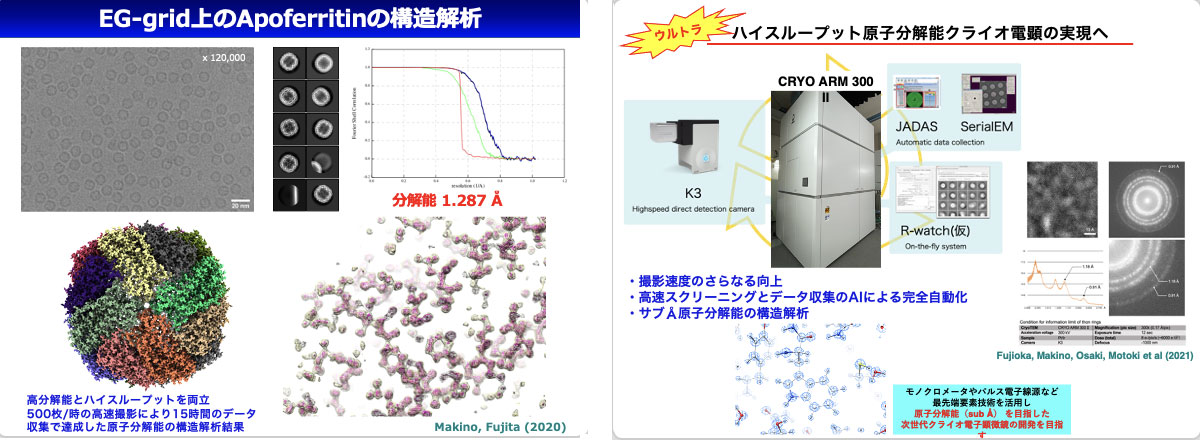
最近の技術進歩により、分子モデルの構築が可能な2~3 Å分解能の構造解析に必要な数千枚の電子顕微鏡像の撮影が数時間で完了するようになった。独自開発の酸化修飾グラフェングリッド(EG-grid)では1枚の画像当たりの分子数が増加し、撮影枚数が数百枚程度でも高分解能構造解析が可能な場合もある。よって最近では1~2日のマシンタイムで複数試料の構造を解析できることも多い。

下の図に示したのは最近の構造解析支援の成果である。
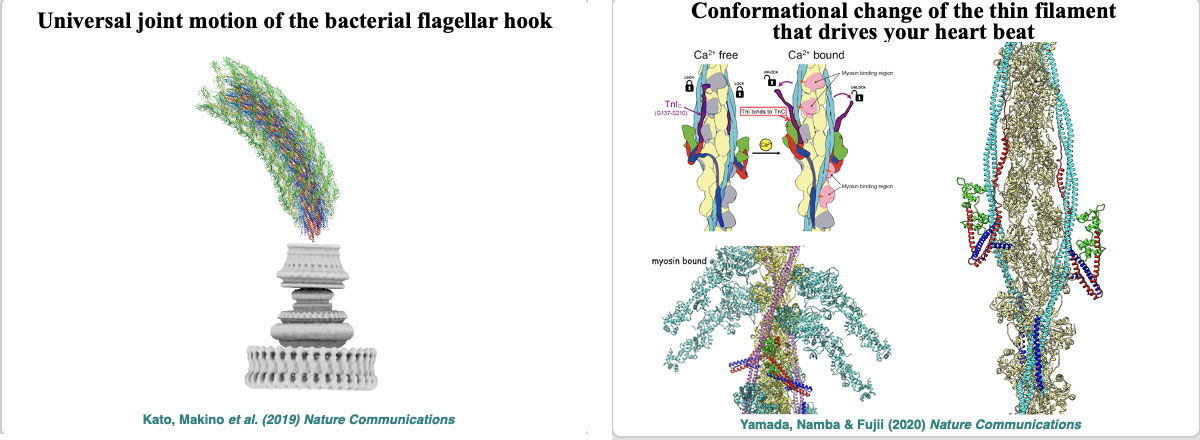
クライオ電子顕微鏡と単粒子像解析法による生体高分子立体構造解析の高速化と高分解能化を目指して、2010年より日本電子社と共同でCRYO ARMの開発を進めてきた。2016年に完成し2017年に安定稼働を開始したCRYO ARM 200 prototypeでは、Gatan K2カメラとの組合せにより撮影速度1,000枚/日での自動撮影が可能になった。高分解能構造解析に少なくとも数千枚の電子顕微鏡像が必要であった細菌べん毛フックの超らせん構造や心筋の細いフィラメントでも構造が解け、立体像マップを基に構築した分子模型から、べん毛フックではそのユニバーサルジョイント機能を支える分子構造変化の動態を可視化し(Kato et al 2019 Nature Commun.)、心筋の細いフィラメントでは心臓の鼓動を駆動する心筋の収縮弛緩を制御する分子メカニズムの解明に成功した(Yamada et al 2020 Nature Commun.)。
2017年に日本電子社が発売したCRYO ARM 300では電子線の干渉性の高いCold Field Emission Gunが搭載された。2019年にはその1号機を用いてapoferritinの構造を解析し、1日で収集した1,000枚のクライオ電顕像から当時の世界最高となる分解能1.53Åを達成して個々の原子の可視化に成功した。その後も高速撮影と高分解能を両立する高度化技術開発を継続し、電子光学系を含む電子顕微鏡制御ソフトの開発により2020年には22,000枚/日(1,000枚/時間)、2021年には29,000枚/日(1,280枚/時間)へと劇的に高速化した。2020年に500枚/時間で15時間、計7,500枚を撮影したapoferritinでは1.29Åを、2021年に1,280枚/時間で1時間、計1,280枚を撮影したapoferritinでは1.49Åを達成した。パイプライン画像解析システムの高度化や深層機械学習人工知能による画像診断技術などを組み合わせ、データ収集の完全自動化を目指す。