| 所属 |
① 京都大学 大学院医学研究科 ② 京都大学 大学院医学研究科 |
|
|---|---|---|
| 氏名 |
① 岩田 想 ② 野村 紀通 |
|
| AMED 事業 |
課題名 | 抗体を用いた膜タンパク質構造研究支援 |
| 代表機関 | 京都大学 | |
| 代表者 | 岩田 想 | |
立体構造認識抗体、膜タンパク質、クライオ電子顕微鏡単粒子解析、機能性抗体、GPCR
①膜タンパク質構造研究用の立体構造認識抗体の作製
当グループは膜タンパク質の親水性表面の立体構造を特異的に認識する抗体(立体構造認識抗体)を高効率で作製する独自技術を保有している。立体構造認識抗体を用いて、多数の膜タンパク質のX線結晶構造解析およびクライオ電子顕微鏡単粒子解析に成功した実績がある。この技術を活用して、BINDS Phase IIの支援の枠組みでは、外部研究者から依頼されたターゲットごとにカスタムメイドの立体構造認識抗体を作製し供給する。外部研究者と共同で膜タンパク質―抗体複合体のクライオ電子顕微鏡単粒子解析を実施し、構造に基づく創薬研究・基礎生命科学の基盤を築く。各年度に10件程度の新規ターゲットの構造認識抗体作製を受け入れる予定である。
マウス免疫では、膜タンパク質精製品を用いて作製したプロテオリポソームを抗原とする。スクリーニング工程では、膜タンパク質を脂質二重膜中に埋め込んだリポソームを結合標的とするELISA(リポソームELISA)および変性状態の膜タンパク質を標的としたELISA(変性ELISA)により膜タンパク質の立体構造を特異的に認識するクローンを選抜する。蛍光ゲル濾過クロマトグラフィー(FSEC)解析により高親和性の立体構造認識抗体を絞り込む。立体構造認識モノクローナル抗体のFabフラグメント精製品を依頼元の外部研究者に提供する。通常は、膜タンパク質精製品を受け取った後、マウス免疫・抗体スクリーニング・Fab精製品生産の全工程を約3か月で完了する。
②GPCR構造研究のための包括的技術
H29~R3年度のBINDS高度化研究において、創薬研究における最重要ターゲットであるGPCRの不活性型・活性型コンフォメーションを包括的に構造解析可能な基盤技術を確立した。各年度に2件程度のGPCR構造解析の支援依頼を受け入れる。
i)活性型GPCRの構造解析:当グループはこれまでに数種類の異なるGPCR/三量体Gタンパク質複合体の構造解析に成功した実績がある(Nojima et al., Structure, 2021; 論文準備中3件ほか)。このノウハウをBINDS支援に供用する。すでにGsαβγ、Giαβγ、Gqαβγ、G12/13αβγといった各種の三量体Gタンパク質の発現精製系を保有している。またこれらの三量体Gタンパク質がターゲットGPCRと複合体を形成しやすいようにデザインしたNanoBiTテザリング (tethering) 技術もすでに整備した。外部研究者から供与されたアゴニスト活性をもつ創薬候補化合物を用いて、GPCR/三量体Gタンパク質複合体を作製し、クライオ電子顕微鏡単粒子解析により活性型GPCRの構造を2.5~3.5Å程度の分解能で決定する。
ii)不活性型GPCRの構造解析:各種GPCRのシグナルを人為的に遮断して細胞機能を制御することは医薬品開発に重要である。アンタゴニストあるいはインバースアゴニスト活性を有する創薬候補化合物のGPCRへの結合様式の解明が焦点となる。当グループはこれまでに多数のアンタゴニスト結合型GPCRの構造解析に成功している。また、アンタゴニストが結合した不活性型GPCR-BRIL融合体の系統的な結晶化に有用なBRIL抗体を開発した(Miyagi et al., Sci. Rep., 2020)。外部研究者から供与されたシグナル遮断あるいは逆作動活性をもつ創薬候補化合物を用いて、X線結晶構造解析により不活性型GPCRの構造を2.5~3.5Å程度の分解能で決定する。
③創薬ターゲット膜タンパク質の細胞外ドメインを認識する機能性抗体の作製支援
当グループはこれまでにGPCR安定化変異体作製技術、種々の融合タンパク質作製技術を有機的に活用し、細胞内ドメインに抗体結合に際して立体障害となる因子(融合タンパク質等)をもった変異体を複数作製し、それを相補的にリポソームELISAの結合標的として用いてサブトラクションスクリーニングを行うことにより、GPCRの細胞外ドメインを特異的に認識する立体構造認識抗体を高効率で選抜する独自技術を持っている(Im et al., Nature Commun., 2020)。また、抗体医薬候補として有用な細胞外ドメイン認識抗体を高効率で取得するためにバキュロウイルス標的ELISA法 (BV-ELISA法)も確立した。外部研究者からの依頼によって、GPCRをはじめとする創薬ターゲット膜タンパク質の細胞外ドメインを認識する機能性抗体を作製する。各年度に1件程度の依頼を受け入れる。
④若手研究員・大学院生等の長期滞在型技術研修
膜タンパク質構造研究の技術・ツールを国内外の創薬・生命科学研究者と積極的に共有する。構造認識抗体の作製、膜タンパク質の発現精製などの技術は、1~2日の座学の講習会で概念を聴講し、原理を頭で理解するだけでは身につかない。当グループの熟練のスタッフと協働するかたちで、現場で現物を見て実際に実験作業に携わりながら、試行錯誤を経験し、成功の喜びもともに体験する中で研究を進めるのが理想的である。様々な研究グループの若手研究員・大学院生が当研究室に長期(1年以上)、あるいは短期(3~6か月)滞在する形での共同研究を受け入れる。研究現場での多様な人々の協働を通して相互の異分野情報交流、経験知の共有・蓄積が可能になり、学際的な研究分野で活躍できるセンスをもった若手人材を育成する。
①膜タンパク質クライオ電子顕微鏡構造解析に必要な構造認識抗体の作製支援
外部研究者から依頼されたターゲットごとにカスタムメイドの構造認識抗体を作製し供給する。外部研究者と共同で膜タンパク質―抗体複合体のクライオ電子顕微鏡単粒子解析を実施する(X線結晶構造解析にも対応可能)。
②創薬リード化合物を用いたGPCRの構造解析支援
外部研究者から供与された創薬リード化合物を用いてGPCR構造解析を行う。抗体の他、各種のGタンパク質複合体を用いて活性型・不活性型GPCRの構造を高分解能で決定する。GPCR―化合物相互作用様式の構造情報を提供し、ヒット化合物創出ユニット及びモダリティー探索ユニットと連携して創薬展開を図る。
③創薬ターゲット膜タンパク質の細胞外ドメインを認識する機能性抗体の作製支援
外部研究者からの依頼によって、GPCRをはじめとする創薬ターゲット膜タンパク質の細胞外ドメインを認識する機能性抗体を作製する。薬効・安全性評価ユニットと連携し、抗体医薬としての評価を行う。
膜タンパク質の精密立体構造をシステマティックかつ網羅的に解明し、その機能を人為的に制御する方策を確立することは、基礎生命科学への貢献として重要であるだけでなく、がん、免疫・アレルギー疾患、生活習慣病、精神・神経疾患、感染症等に効果のある医薬品開発への展開が期待されるため社会的要請も大きい。
膜タンパク質構造研究の分野では、過去10年間にX線結晶構造解析およびクライオ電子顕微鏡単粒子解析の技術革新が国内外で急速に進み競争が激化した。Gタンパク質共役受容体 (GPCR)については、膜貫通ヘリックス部分への安定化変異導入、結晶性の高い可溶性タンパク質BRILを細胞内ループ等に融合するタンパク質工学技術等を駆使して、安定性や結晶性の改善に成功した場合にはX線結晶構造解析が比較的スムースに進められる状況になっている。また大きな膜外ドメインがあり、かつ対称性の高いオリゴマー構造を持つ高分子量膜タンパク質のクライオ電子顕微鏡単粒子解析の成功例もこの3~4年で急増した。クライオ電子顕微鏡単粒子解析が第一選択の手法として選ばれる傾向が強くなってきている。しかしながら、まだ構造が解かれていないGPCRやトランスポーターなどの創薬ターゲット膜タンパク質の多くは分子量が40~60kDaと小さく、膜外ドメインが小さいため、最新のクライオ電子顕微鏡単粒子解析技術を用いてもその精密立体構造決定は依然として難度が非常に高い。
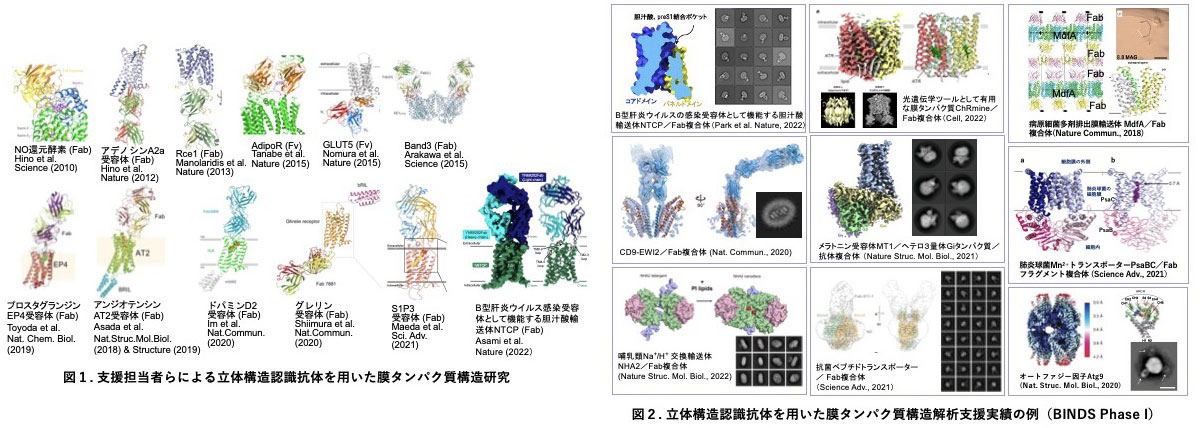
当グループは世界最高水準の研究者たちと競争・協力しつつ、膜タンパク質の親水性表面の立体構造を特異的に認識する抗体(構造認識抗体)を高効率で作製する独自の技術を確立し(特許出願PCT/JP 2010/057631)、抗体を用いた膜タンパク質のX線結晶構造解析およびクライオ電子顕微鏡単粒子解析で多くの実績を上げてきた(図1)。また、H29~R3年度のBINDSの支援の枠組みではこの抗体技術を広く外部研究者に供用し、10件以上の膜タンパク質のX線結晶構造解析およびクライオ電子顕微鏡単粒子解析に成功した (Nagarathinam et al., Nat. Commun., 2018;Umeda et al., Nat. Commun., 2020; Matoba et al., Nat. Struc. Mol. Biol., 2020; Okamoto et al., Nat. Struc. Mol. Biol., 2021; Ghilarov et al., Science Adv., 2021; Neville et al., Science Adv., 2021; Kishi et al., Cell, 2022; Park et al., Nature, 2022 ほか。図2)。支援研究を進める中で「ターゲット膜タンパク質に構造認識抗体を結合させた場合、抗体がクライオ電子顕微鏡単粒子画像の正確かつ効率のよいアライメントを可能にするマーカー(fiducial marker)として機能するため、膜タンパク質の構造解析の成功率が飛躍的に向上する」という概念実証 (POC) を国内外の研究者と協力していち早く広範に実施し、膜タンパク質のクライオ電子顕微鏡単粒子解析における構造認識抗体の有用性を立証した。