| 所属 |
① 東京大学 定量生命科学研究所 ② 名古屋大学 工学研究科 |
|
|---|---|---|
| 氏名 |
① 胡桃坂 仁志 ② 林 剛介 |
|
| AMED 事業 |
課題名 | エピジェネティクスの基盤原理解明と創薬のためのヒストンおよび再構成クロマチンの生産 |
| 代表機関 | 東京大学 | |
| 代表者 | 胡桃坂 仁志 | |
ヒストン、ヌクレオソーム、クロマチン、修飾ヒストンペプチド
真核生物のゲノムDNAは様々な細胞核内タンパク質と結合したクロマチンと呼ばれる構造体として、核内に収納されている。クロマチンはダイナミックに構造変動することで、転写、複製、修復、組換えなどのDNA機能を制御している。クロマチンの構造変動は、クロマチン構成タンパク質であるヒストンの翻訳後修飾、ヒストンの亜種であるヒストンバリアント群、DNA結合因子群、ヒストン結合因子群、クロマチン構造変化に関わるタンパク質群などのエピジェネティックな要因によって複雑かつ厳密に制御されると考えられる。このようなクロマチンの構造変動を介したDNA機能発現制御を理解するためには、高純度に調製されたヒストン、クロマチンの最小ユニットであるヌクレオソーム、及びクロマチンを用いた研究を行うことが必要不可欠である。本事業では、補助事業代表者である胡桃坂の有する、多種多様なヒストンの精製技術及び再構成ヌクレオソーム・ポリヌクレオソームの調製技術と、補助事業分担者である林の有する、多様な翻訳後修飾を導入したヒストンペプチド及び全長ヒストンの化学合成技術を用いて支援を行う。具体的には、胡桃坂の有するヒストン、ヒストンバリアント、修飾模倣ヒストン、ヒストン変異体、多様な生物種のヒストンなどを含む506種類のヒストンと、林の修飾ヒストンペプチド及び修飾ヒストンの生産及び供給、それらのヒストン群を用いた再構成ヌクレオソーム、ポリヌクレオソームの調製及び供給を行う(下図)。これらの支援により、クロマチン研究及びエピジェネティクス研究の飛躍的な促進が期待できる。
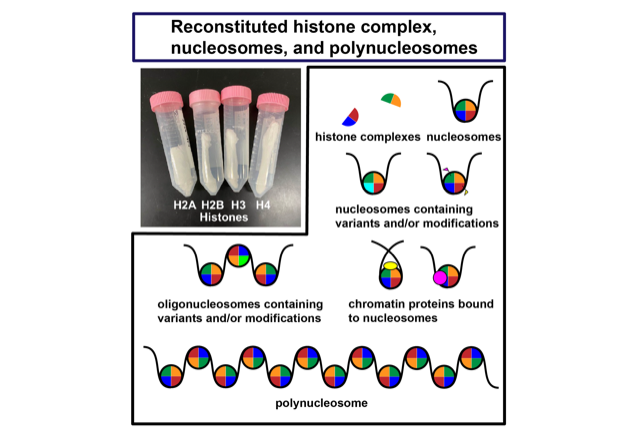
真核生物の細胞核内において、ゲノムDNAは4種類のヒストンタンパク質が2分子ずつ含まれるヒストン8量体に巻きついたヌクレオソームと呼ばれる構造体として、コンパクトに折り畳まれ収納されている。4種類のヒストンには多様なバリアントやメチル化、アシル化、リン酸化、ユビキチン化などの修飾状態が存在し、これらが転写活性化領域や不活性化領域などの特徴的なクロマチン領域に取り込まれることがわかっている。このようなDNA配列に依らない多様なエピゲノム状態によって、転写、複製、修復、組換えなどのDNA機能発現が厳密に制御されている。このようなエピジェネティックなDNA機能発現制御機構の破綻は、がん、感染症、メタボリックシンドローム、精神疾患などの様々な疾病の原因になることが明らかになってきた。それゆえに、DNA機能発現制御機構を理解することは、生命現象の理解にとどまらず、様々な疾病に対する新規の診断法や治療法の確立にも大いに貢献することが期待される。そこで、私たちは、これまでに多様なヒストンバリアント、翻訳後修飾模倣ヒストン、がん関連変異ヒストンなどをリコンビナントタンパク質として精製し、これらのヒストンを含むヌクレオソームやポリヌクレオソームの生化学的解析及び構造生物学的解析を行ってきた。さらに、高難度クロマチン試料の調製にも取り組み、12個のヌクレオソームが連なったポリヌクレオソームや特定の位置にヒストンバリアント、ヒストン修飾を模倣した化学修飾を含むオリゴヌクレオソーム、ヌクレオソームとクロマチン結合因子との複合体、転写伸長中のRNAポリメラーゼ及び転写伸長因子群とヌクレオソームとの複合体の調製、及び生化学的解析、構造生物学的解析に成功している。