| 所属 |
① 九州大学 大学院薬学研究院 ② 九州大学 大学院薬学研究院 |
|
|---|---|---|
| 氏名 |
① 小柳 悟 ② 松永 直哉 |
|
| AMED 事業 |
課題名 | グリーンファルマ創薬構造解析による支援高度化の推進 |
| 代表機関 | 九州大学 | |
| 代表者 | 大戸 茂弘 | |
薬物動態、ADME、概日リズム
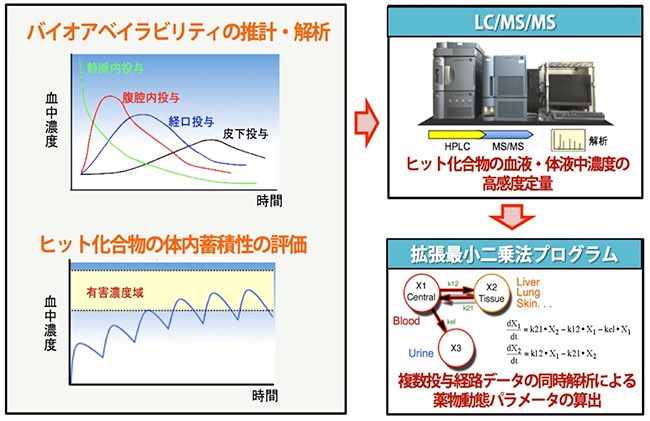
生体試料中におけるヒット化合物の高感度検出法を構築し、疾患モデルの対象となるマウス・ラットを用いてヒット化合物の体内動態解析を行う。得られたデータから吸収・分布・代謝・排泄に関する情報・パラメータを算出し、至適投与量と至適投与法を提案する。
化学反応でタンパク質の機能を阻害する新しい分子デザインを見出し、これを応用して強い薬効と高い安全性を併せ持つ抗がん剤を開発したが動物の体内動態は不明だった。そこで実験動物に開発した抗がん剤を投与して体内動態を解析した。その結果、既存薬と異なる体内挙動を示すことを明らかにした。
・Sato M et. al, ACS Med Chem Lett, 11,1137-1144.2020
・Shindo N et al., Nat Chem Biol, 15,250-258. 2019
化学反応でタンパク質の機能を阻害する強い薬効と高い安全性を併せ持つ新たな抗がん剤を開発したが、ヒトにおける代謝安定性は不明だった。そこでヒトの血清または肝臓から採取したミクロソームを用いて、代謝安定性を解析した。その結果、開発した複数の抗がん剤の中から優れた代謝安定性を示すものを見出すことに成功した。
・Tokunaga T et al., J Am Chem Soc.142,18522-18531.2020
既存薬の新たな薬効を見出したが、病巣部位への移行性に問題があり、経口投与では効果を発揮することができないものだったが、他の既存薬との併用により病巣部位への移行性が改善して経口投与でも薬効を示すことができるようになった。
・Yasukochi et al., Biochem Pharmacol, 185, 114411, 2021
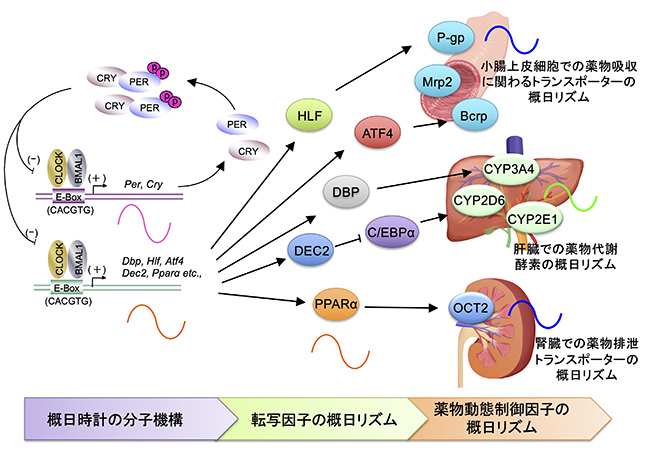
一般に薬の効果は作用部位における「薬物への感受性」と、その部位における「薬物の濃度」によって規定されるが、病巣部位へ薬の移行や速さは吸収・分布・代謝・排泄の各素過程によって制御されている。ヒトにおける薬物の体内動態に服用時刻による違いがあることは知られていたが、その制御メカニズムは十分に解明されていない。私たちは培養ヒト肝細胞を用いた実験で、薬物代謝酵素であるシトクロムP450の発現や活性が時計遺伝子のはたらきによって概日リズムを示す機構を明らかにした。また、トランスポーターも薬物の体内動態制御に関わる重要な因子だが、動物やヒト腎臓の近位尿細管細胞を用いた実験において、トランスポーターの薬物輸送能が概日リズムを示すメカニズムの解明にも成功した。さらに、製薬企業と共同でサルを用いた研究を実施し、マウス・ラットなどの夜行性動物と昼行性動物における概日リズム制御機構の種差を明らかにした。サルはヒトと同じ昼行性動物であり、シトクロムP450や薬物輸送トランスポーターをコードする遺伝子は両種間で高い相同性を示すことから、得られたデータをもとにヒトにおける至適投薬タイミングの設定が可能になることが期待される。