| 所属 |
① 東北大学 未来型医療創成センター ② 東北大学 大学院生命科学研究科 |
|
|---|---|---|
| 氏名 |
① 小柴 生造 ② 田中 良和 |
|
| AMED 事業 |
課題名 | ゲノム・オミックス・タンパク質構造情報を活用したアカデミア発の創薬支援 |
| 代表機関 | 東北大学 | |
| 代表者 | 山本 雅之 | |
クライオ電子顕微鏡、単粒子解析、クライオ電子線トモグラフィー法、クライオ電顕データ取得、構造解析
本支援では、東北大学・未来型医療創成センターにAMED・BINDSの支援の元に設置されたクライオ専用の300kVハイエンド透過型電子顕微鏡 日本電子社製CRYO ARM 300 IIを活用し、グリッド作成から構造解析にいたるクライオ電子顕微鏡による構造解析全般の技術支援を行う(図1)。また、同様にBINDSの支援の元に設置されたクライオ専用の集束イオンビーム・走査型電子顕微鏡 日本電子社製JIB-4700Fを活用し、細胞内の高分子複合体の構造解析を行うクライオ電子線トモグラフィー法の技術支援も行う(図2)。
さらに、本学東北メディカル・メガバンク機構に設置されているスーパーコンピュータを活用してクライオ電子顕微鏡の膨大なデータをハイスループットに解析できる最先端の解析環境を提供する。また、化合物スクリーニングで得られたヒット化合物について、SBDD(Structure-based drug design)のための支援を行うとともに、対象分子の性質によってはNMRやX線結晶構造解析による構造解析支援も検討する。
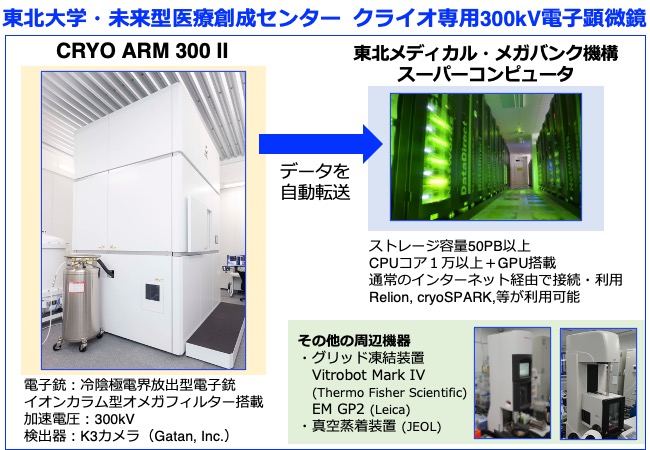
(図1)

(図2)
東北大学・未来型医療創成センターのクライオ専用の300kVハイエンド透過型電子顕微鏡を活用して、令和3年度よりAMED・BINDSの構造解析支援を開始し、これまでに約30件の支援を行ってきた(下図)。支援に際しては、グリッド作成、データ収集から構造解析まで様々なコンサルティングや支援をする。特に単粒子解析を中心とした構造解析支援を行うとともに、東北大メディカル・メガバンク機構が掲げる個別化医療と連携して高度化を進める。さらにスーパーコンピュータ上に構築した解析環境も支援の一環として提供している。
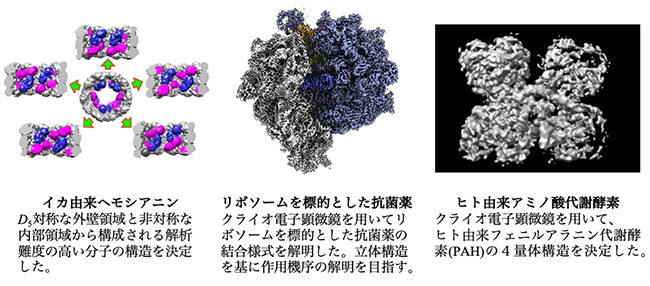
(図3)
令和2年度末にAMED・BINDSの支援により、東北大学・未来型医療創成センターにクライオ専用の300kVハイエンド透過型電子顕微鏡が新たに導入された。そして令和3年9月よりAMED・BINDSの構造解析支援を開始しており、既に30件を超える支援を進めている(下図)。支援に際しては、グリッド作成、データ収集から構造解析まで様々なコンサルティングや支援をする。特に単粒子解析を中心とした構造解析支援を行うとともに、東北大メディカル・メガバンク機構が掲げる個別化医療と連携して高度化を進める。また令和6年度より新たに導入した集束イオンビーム・走査型電子顕微鏡によるクライオ電子線トモグラフィー法の技術支援も開始する。
小柴研究室
本研究室が所属する東北大学・未来型医療創成センターでは、次世代医療の実現に向けて様々な取り組みを進めている。本センターは本学の10部局(医学系研究科、大学病院、薬学研究科、生命科学研究科、東北メディカル・メガバンク機構など)が連携して進めている組織で、幅広い分野の研究者が研究を実施している。その中で本研究室は、クライオ電子顕微鏡を用いて疾患に関わる各種タンパク質の立体構造・機能解析を行うと共に、化合物スクリーニング等の研究者と連携して創薬にむけた取り組みを進めている。また、一般人の健康調査を実施している本学東北メディカル・メガバンク機構と連携して、同機構の全ゲノム解析が明らかにしたヒトのゲノムに存在する膨大な変異について、タンパク質の立体構造情報やメタボローム等の各種オミックス解析情報を活用してその影響を明らかにすることを目指している。また本研究室はクライオ電子顕微鏡の他にも、高感度高磁場溶液NMR装置(800&600MHz)や、LC-MS、GC-MS等の各種質量分析装置(Thermo Fisher Scientific, Waters, 島津)等を運用しており、各種分析に対応している。
本研究室では、タンパク質の発現・精製から、クライオ電子顕微鏡による測定、さらには得られたデータの解析まで一連の構造解析に関する支援を行うことができる。また対象分子の性質によってはNMRによる解析支援も可能である。さらに当室では集束イオンビーム・走査型電子顕微鏡を用いて様々な試料の観測や加工も行っており、クライオ電子線トモグラフィー法の支援も可能である。
田中研究室
田中良和はこれまで、毒素をはじめとした疾患に関連するタンパク質や、セントラルドグマ・酸素運搬など生命の根幹をなす重要なタンパク質の構造機能解析に取り組んできた(Tanaka et al., JBC 2007; Tanaka et al, Structure 2008; Tanaka et al., RNA 2009; Yamashita et al., PNAS 2011; Yu et al., PNAS 2011; Yamashita et al., Nat. Commun. 2014; Gai et al., Structure 2015; Chen et al., PNAS 2017; Chen et al., Commun. Biol. 2020; Wakui et al., Chem. Sci. 2020 etc)。クライオ電顕を用いた成果だけでなく(Tanaka et al., IUCrj 2019; Tomono et al., J Biochem 2024; Noba et al., ACS Syn Biol 2023; Chattrairat et al., Device 2024)、ネガティブ染色法による電子顕微鏡単粒子解析の実績もある(Chen et al., Nat. Commun. 2017; Makabe et al., Sci. Rep. 2021; Ghanem et al., FEBS J. 2022 et al)。最近は、膜蛋白質のクライオ電顕単粒子解析でも成果を上げつつあるほか、海洋天然物からの有用分子の取得とそれを利用した創薬研究にも取り組んでいる(Watari et al., Nat Commun 2022; 特願2022-013983)。
横山武司は、これまで遺伝子発現機構の解明を目的とし、関連する超分子複合体の構造解析をクライオ電子顕微鏡を用いて取り組んできた(Yokoyama et al., Mol Cell 2019; Kashiwagi et al., Science 2019; Murayama et al., Sci Adv 2023; Zhao et al., Cell 2023; Akiyama et al., Nat Struct Mol Biol 2024)また、本支援が拠点とする東北大学INGEMのCRYO ARM 300 IIを駆使して、世界に先駆けて植物におけるホウ素の取り込み制御機構にリボソームが関わる様子を高分解能で可視化した(Tanaka, Yokoyama, Saito et al., Nat Chem Biol 2024).さらに、新規抗菌薬による翻訳阻害機構解明や(Isozaki et al., Sci Adv 2025)、解析のための新たな手法DARC法の開発にも取り組んでいる(Tomono et al., J Biochem 2024).
以上のこれまでの研究実績に基づき、田中・横山班では、電子顕微鏡を用いたタンパク質構造解析(ネガティブ染色法、クライオ電顕)に関する広い支援が可能である。