| 所属 |
① 群馬大学 生体調節研究所 ② 群馬大学 生体調節研究所 ③ 群馬大学 生体調節研究所 |
|
|---|---|---|
| 氏名 |
① 畑田 出穂 ② 堀居 拓郎 ③ 森田 純代 |
|
| AMED 事業 |
課題名 | ゲノム、エピゲノム編集疾患モデル動物の作出支援 |
| 代表機関 | 群馬大学 | |
| 代表者 | 畑田 出穂 | |
Floxマウス、ノックアウトマウス、ノックインマウス、エピゲノム編集マウス、ゲノム編集マウス
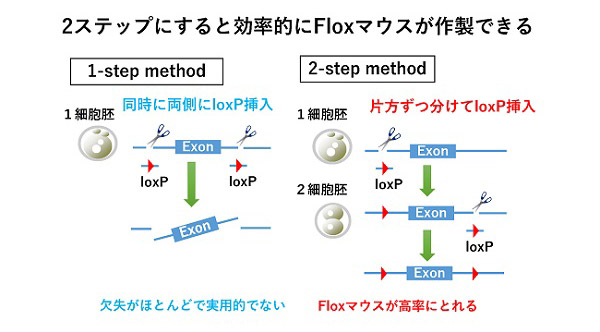
2ステップ法で高速にFloxマウスを作製
1ステップ法(従来法)では、ゲノムの近接2箇所を切られたことによる染色体欠失が高頻度に起こりFloxマウスはほとんど得られない。我々が開発した2ステップ法では1ステップでloxPを挿入するのではなく、1箇所ずつ受精卵と2細胞期胚に2ステップに分けてloxPを挿入することにより染色体欠失を回避する。この方法により染色体欠失が減少し高効率にFloxマウスを得ることができる(Sci Rep. 2017, 7:7891)。この技術を用いてFloxマウス作製支援を行う。その他、Creを封入した脂質ナノ粒子(LNP)によるコンディショナルノックアウトマウス作製支援も行う。
エレクトロポーレーション法で高速にノックアウトマウス、ノックインマウスを作製
エレクトロポーレーション法とCRISPR/Cas法を組み合わせて高速にノックアウトマウス、ノックインマウスの作製支援を行う。
エピゲノム編集マウスを作製
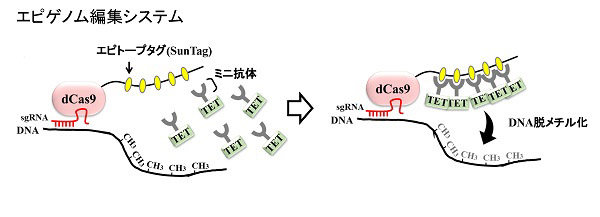
我々は特定の遺伝子のエピゲノムを操作するエピゲノム編集技術(Nat Biotechnol. 2016, 34:1060-1065)を開発した(図2)。この技術では(1)dCas9の端に複数のエピトープタグ(SunTag)を連結したものと(2)タグを認識して結合するミニ抗体に脱メチル化酵素TETを連結したものを同時に細胞に導入して複合体を構成させ、標的遺伝子に多くのTETをリクルートすることで効果的に脱メチル化が起こる。この技術を用いたエピゲノム疾患モデル作製支援を行う。
作製した疾患モデル動物を用いた標的遺伝子の評価・薬剤試験、エピゲノム解析支援で発見した標的遺伝子のエピゲノム編集マウス作製。

高速コンディショナルノックアウトマウス法の開発
2ステップ法で高速にコンディショナルノックアウトマウスを作製する方法を開発した。この方法では受精卵と2細胞期に分けてexonの左右にloxPを挿入する。これにより、従来法において同時にloxPを挿入することによって起こっていた染色体欠失を回避し、高効率でFloxマウスを作製できる。またこの方法を用いて組織特異的Cre発現マウスの受精卵から直接Flox/Creマウスの作製にも成功した(Sci Rep. 2017, 7:7891)。
参照リンク
https://www.amed.go.jp/news/release_20170811.html
エピゲノム疾患モデル動物の開発
遺伝子切断活性をなくしたCas9(dCas9)と、DNAの脱メチル化の最初の反応を起こす酵素(TET)を直結し、TETの活性を標的遺伝子にリクルートしたが、十分に発現を活性化できなかった。そこで、脱メチル化能力を向上させるため、(1)dCas9の端に短い目印のアミノ酸配列(GCN4)を複数個つないだものと(2)GCN4を認識して結合するミニ抗体にTETをつなげたものを同時に細胞に導入して新規複合体を構成させる方法を開発した。これにより特定の遺伝子に複数のTETが作用し、効率的に脱メチル化し遺伝子発現を十分に上昇させることができた。一方、標的の遺伝子以外ではまったく脱メチル化が見られず特異性が高いことがわかった(Nat Biotechnol. 2016, 34:1060-1065)。この技術をさらに応用発展させ個体レベルでエピゲノムだけを改変したエピゲノム疾患モデル動物を作成した(Genome Biology 2020, 21:77)。