| 所属 |
① 東京大学 大学院薬学系研究科 ② 北里大学 薬学部 |
|
|---|---|---|
| 氏名 |
① 楠原 洋之 ② 前田 和哉 |
|
| AMED 事業 |
課題名 | 新規薬効成分の薬物動態解析と体内動態特性予測の支援 |
| 代表機関 | 東京大学 | |
| 代表者 | 楠原 洋之 | |
初代培養細胞、薬物代謝、薬物輸送、in vitro-in vivo extrapolation
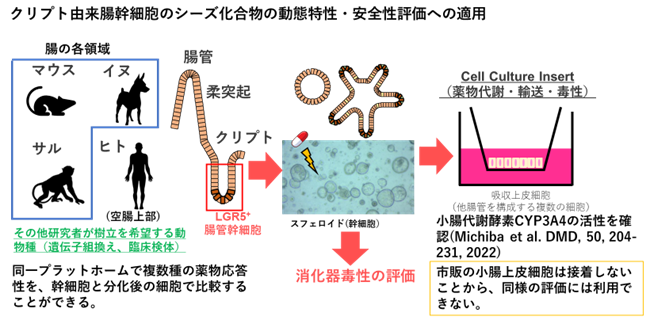
実験動物の種間、また実験動物とヒトとの間には種差が存在しているため、実験動物を用いて得られた薬物動態試験の結果をそのままヒトでの薬物動態特性と同じとして見なすことは困難であることが、これまでの数多くの研究から実証されている。一方、シーズ化合物を臨床ステージへと進めるためには、ヒトにおいても十分な薬物暴露が得られるよう構造展開する必要があり、ヒト由来試料を用いたin vitro試験による評価が行われている。薬物動態の観点から特に重要な臓器としては、薬物のクリアランス臓器である肝臓や腎臓、経口剤の吸収を決定する臓器である小腸が挙げられる。肝臓では薬物代謝や肝取り込み・胆汁排泄が、腎臓では糸球体ろ過に加えて、尿細管分泌や再吸収がクリアランスの決定要因である。とりわけ肝臓は、経口投与時に循環血に薬物が到達する経路上にも存在し、消化管から循環血への薬物の移行率(バイオアベイラビリティ)を決定する重要な臓器でもある。薬物動態関連分子(代謝酵素やトランスポーター)が発現しているのは肝実質細胞であるが、現在では市販品としてヒト凍結肝細胞を入手可能であり、薬物動態研究に繁用されている。ヒト凍結肝細胞を遊離もしくは接着の状態で薬物代謝・輸送を評価してin vitroパラメータを取得後、各パラメータを細胞数や臓器重量等で補正し、in vivoにおける代謝・輸送パラメータへと外挿することで、静注あるいは経口投与後のシーズ化合物の暴露を推定することが可能である。一方、ヒト腸管は摘出後ごく短時間しか薬物の経口吸収の評価に必須とされる薬物輸送機能を維持できないという短所があった。腸管クリプト由来幹細胞は単離後、凍結保存・拡大培養が可能といったメリットがあり、小腸吸収上皮細胞に分化後、薬物代謝・透過性評価試験に利用することが可能である。これまでマウス、イヌ、サル、ミニブタから同技術を利用して細胞を樹立しており、必要に応じて提供や技術指導も可能である。研究者の希望する実験動物(持ち込み)、希望する動物種や消化管部位から腸管細胞の樹立や機能評価の支援も行う。ヒト細胞に関しても、研究者の希望に応えられるよう、倫理申請などの文書作成の支援も行う。薬物動態試験だけではなく、肝細胞、腸管細胞(未分化、分化後)を利用して、シーズ化合物の安全性評価も行うことが可能である。ラット・サルと動物種は限られるが、ファーマコセル社のBBBキットの利用経験もあることから、血液脳関門透過性のin vitro評価も支援する。
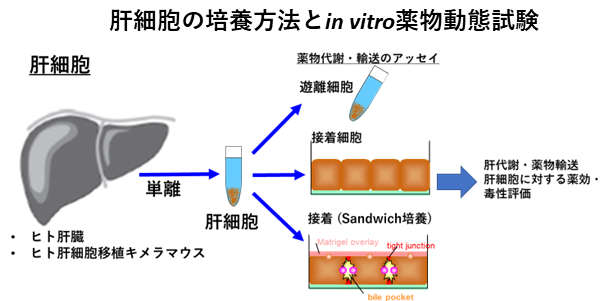
・シーズ化合物のヒト体内動態特性を評価するため、肝細胞や肝ミクロソームを用いたシーズ化合物の安定性試験を行い、その評価結果をin vivoへと適切に補外する。その結果に基づいて、薬物動態特性の観点からシーズ化合物間の優劣をつけるなど選別を進める。あるいは、薬物動態特性を改善するための構造展開の提案を実施する。
・シーズ化合物の消化管吸収性を評価するため、腸クリプト由来幹細胞を小腸吸収上皮細胞へと分化させた後、シーズ化合物の細胞透過性を評価する。
・薬剤誘導性の肝毒性、消化器毒性を評価するため、培養した肝細胞・腸管細胞に薬物を暴露して、viabilityやATPレベルなど各種パラメータを計測する。
・ヒト腸管細胞を薬物動態研究・安全性研究へと利用するため、倫理委員会へ提出する文書作成を支援する。
・研究者が樹立した遺伝子改変動物、実験動物種から、腸クリプト由来幹細胞を樹立し、3次元培養あるいは平面培養により、研究者が希望する機能評価の支援を行う。摘出臓器をそのまま送付いただく場合、摘出後1日以内であれば、臓器検体より比較的良好なviability・細胞数の腸管クリプト由来幹細胞を樹立した経験を有している。
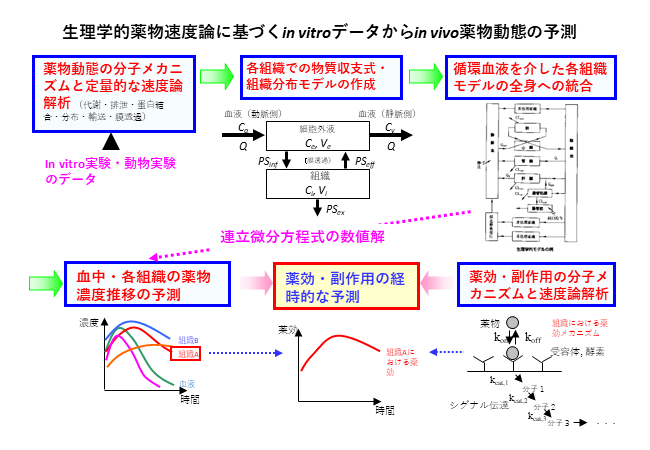
楠原と前田は、①体内動態に関連する分子、主にトランスポーターによる組織分布・排泄の重要性を解明することを目的として、胆汁排泄や尿排泄など実験動物におけるin vivo薬物動態試験、②in vivoデータをサポートするため、肝臓などの初代培養細胞や薬物トランスポーターの強制発現系などin vitroモデルの開発、③ヒトにおける薬物動態や医薬品を複数服用した際の体内動態の変動(薬物相互作用)を予測するため、in vitroデータの外挿方法(in vitro-in vivo extrapolation/in vitro-in vivo correlation)を開発してきた。薬物速度論に基づいて、薬物固有の動態特性を表すパラメータを決定することで、体内動態におけるトランスポーター分子の重要性を定量的に評価してきた。特に研究②では、実験動物に加えて、ヒト由来試料として、ヒト肝細胞(遊離あるいは接着型)を用いた薬物輸送試験、代謝試験の実績を有する。さらに最近、腸管クリプト由来幹細胞を拡大培養し、その後分化させることで、小腸における薬物吸収・代謝をin vitroで評価する試験系を確立し、in vitroモデルにおける薬物動態関連分子の重要性を評価する実験系を確立している。幹細胞を拡大培養し得られるスフェロイドや、分化誘導後の小腸吸収上皮細胞を含むスフェロイドを調製し、薬物動態・毒性試験における有用性の実証へ向けた研究を展開している。腸管クリプト由来幹細胞については、実験動物に加えて、ヒト由来細胞の構築にも取り組んでいる。In vitro試験系で評価した薬物動態パラメータを数多く収集すると共に、生体における組織重量や血流速度等生理学的なパラメータも考慮した薬物動態の数理モデルを構築し、個体レベルへの薬物動態特性の外挿法、既存薬物のin vitroデータと臨床データを参照し、その相関関係に基づいて予測性を改善する方法(研究③)も開発してきた。また、薬物動態研究として、健常人を対照とした臨床研究(特定臨床研究)により、in vitro試験の予測結果を検証することにも取り組んでいる。 研究室HP:https://dotai.f.u-tokyo.ac.jp/ja/index.html